Автор: Gammone MA, D'Orazio N
18.04.2020 в 0:00
Активность морского каротиноида фукоксантина против ожирения
Абстракто:
В настоящее время глобальная тенденция к снижению физической активности и увеличению потребления жиров, сахаров и калорий с пищей приводит к растущему распространению избыточного веса, ожирения и заболеваний, связанных с образом жизни, таких как диабет, гипертония, дислипидемия и метаболический синдром. В частности, ожирение, характеризуемое как состояние вялотекущего воспаления, является мощной детерминантой как в развитии резистентности к инсулину, так и в развитии диабета 2 типа. Несколько молекулярных мишеней дают надежду на терапию против ожирения. Одним из ключей к успеху может быть индукция разобщающего белка 1 (UCP1) в абдоминальной белой жировой ткани (WAT) и регуляция секреции цитокинов как абдоминальными жировыми клетками, так и клетками макрофагов, проникшими в жировую ткань. Эффекты против ожирения фукоксантина, характерного каротиноида, точно принадлежащих ксантофиллам. Нутригеномные исследования показывают, что фукоксантин индуцирует UCP1 в митохондриях WAT брюшной полости, что приводит к окислению жирных кислот и выработке тепла в WAT. Фукоксантин улучшает резистентность к инсулину и снижает уровень глюкозы в крови за счет регуляции секреции цитокинов WAT. Предполагается, что ключевой структурой эффекта против ожирения является каротиноидный конец полиенового хромофора, который содержит аллельную связь и две гидроксильные группы. Фукоксантин, который можно выделить из съедобных бурых водорослей, недавно продемонстрировал свои многочисленные физиологические функции и биологические свойства. Мы рассмотрели недавние исследования, и эта статья призвана объяснить основные предпосылки фукоксантина, сосредоточив внимание на его многообещающих потенциальных эффектах против ожирения.
1. Введение
Современный образ жизни, характеризующийся высоким потреблением жиров, сахаров и калорий, а также снижением физических нагрузок и физической активности, способствует возникновению метаболических и воспалительных заболеваний, таких как ожирение, диабет, гипертония, рак и другие хронические патологии. Питание может играть важную роль в предотвращении этих нарушений, связанных с образом жизни, и желательно найти в продуктах питания безопасные и эффективные функциональные ингредиенты. Важность морских водорослей как источников функциональных ингредиентов хорошо известна благодаря их ценным полезным для здоровья эффектам. Поэтому выделение и исследование новых биоактивных ингредиентов с биологической активностью из морских водорослей в последнее время привлекли большое внимание. Среди функциональных ингредиентов, идентифицированных из морских водорослей, особый интерес вызвал фукоксантин. Исследователи сосредотачиваются на функциональных ингредиентах в пищевых продуктах как для профилактики, так и для лечения заболеваний, связанных с образом жизни. В этом отношении морские биологически активные вещества, такие как морские каротиноиды, особенно фукоксантин, в последнее время привлекают внимание. Фукоксантин представляет собой морской каротиноид, который можно найти в обеих макроводорослях, таких как Undaria pinnatifida или Laminaria japonica.и микроводоросли, такие как Phaeodactylum tricornutum или Cylindrotheca closterium. Фукоксантин показал антиожирительную, антидиабетическую, антиоксидантную, противовоспалительную и противораковую активность. Учитывая уникальную структуру фукоксантина, его метаболизм, его безопасность, а также его значительную биологическую активность и фармакологические эффекты, он может стать перспективным пищевым ингредиентом и потенциальным лекарственным компонентом для здоровья человека.
2. Структура и метаболизм фукоксантина
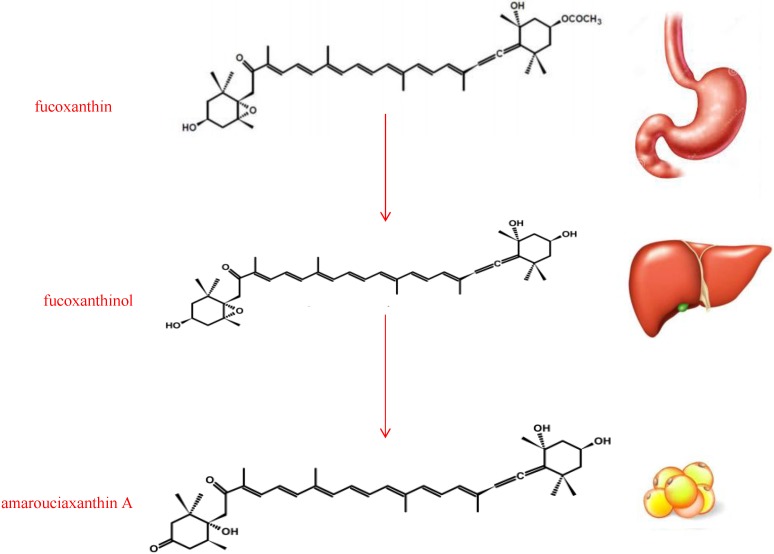
Каротиноиды, группа фитохимических веществ, отвечающих за цвет некоторых пищевых продуктов, играют важную роль как в профилактике заболеваний человека, так и в поддержании хорошего здоровья. По источнику их подразделяют на морские и наземные, по химическому строению — на каротины и ксантофиллы. Каротины не содержат кислорода, жирорастворимы и нерастворимы в воде (в отличие от других каротиноидов, ксантофиллов, которые содержат кислород и поэтому менее гидрофобны химически); каротины включают бета-каротин и ликопин. Ксантофиллы - это желтые пигменты, название которых связано с образованием у них желтой полосы, наблюдаемой в ранней хроматографии пигментов листьев. Их молекулярная структура похожа на каротины, но ксантофиллы содержат атомы кислорода, тогда как каротины представляют собой чистые углеводороды без кислорода. Ксантофиллы содержат свой кислород либо в виде гидроксильных групп, либо в виде пар атомов водорода, которые замещены атомами кислорода, действующими как мостик (эпоксид). По этой причине они более полярны, чем чисто углеводородные каротины, и именно это различие позволяет отделить их от каротинов во многих типах хроматографии. Как правило, каротины имеют более оранжевый цвет, чем ксантофиллы. В группу ксантофиллов входят (среди многих других соединений) фукоксантин, лютеин, зеаксантин, неоксантин, кантаксантин, виолаксантин, капсорубин, астаксантин и α- и β-криптоксантин. и именно это различие позволяет отделить их от каротинов во многих типах хроматографии. Как правило, каротины имеют более оранжевый цвет, чем ксантофиллы. В группу ксантофиллов входят (среди многих других соединений) фукоксантин, лютеин, зеаксантин, неоксантин, кантаксантин, виолаксантин, капсорубин, астаксантин и α- и β-криптоксантин. и именно это различие позволяет отделить их от каротинов во многих типах хроматографии. Как правило, каротины имеют более оранжевый цвет, чем ксантофиллы. В группу ксантофиллов входят (среди многих других соединений) фукоксантин, лютеин, зеаксантин, неоксантин, кантаксантин, виолаксантин, капсорубин, астаксантин и α- и β-криптоксантин, который является единственным известным ксантофиллом, содержащим бета-иононовое кольцо; таким образом, β-криптоксантин является единственным ксантофиллом, который, как известно, обладает активностью провитамина А для млекопитающих. У видов, отличных от млекопитающих, некоторые ксантофиллы могут быть преобразованы в гидроксилированные аналоги сетчатки, которые функционируют непосредственно в зрении. Они обладают потенциальными антиоксидантными биологическими свойствами из-за своей химической структуры и взаимодействия с биологическими мембранами. Их антиоксидантные свойства считаются основным механизмом, благодаря которому они оказывают благотворное влияние на здоровье. Однако было бы упрощением объяснять физиологические эффекты каротиноидов исключительно их антиоксидантной активностью. В общем, концентрация каротиноидов в плазме отражает концентрацию, содержащуюся в пище. Фукоксантин (Рисунок 1) представляет собой ксантофилл, чья особая структура включает необычную аллельную связь, эпоксидную группу и сопряженную карбонильную группу в полиеновой цепи с антиоксидантными свойствами. Пищевой фукоксантин подвергается метаболическому превращению в амаруциаксантин А через фукоксантинол у мышей, которым требуется никотинамидадениндинуклеотидфосфат (НАДФ+) в качестве кофактора, он гидролизуется до фукоксантинола в желудочно-кишечном тракте под действием пищеварительных ферментов, таких как липаза и холестеринэстераза, и превращается в амаруциаксантин А (фигура 2) в печени. Биоконверсия фукоксантинола в амароуциаксантин А посредством дегидрирования/изомеризации в основном была показана в микросомах печени. Процентное содержание фукоксантина, фукоксантинола и амаруциаксантина А в жировой ткани составляло 13%, 32% и 55% соответственно, тогда как процентное содержание в других тканях, таких как печень, легкие, почки, сердце и селезенка, составляло 1 %-11%, 63%-76% и 20%-26% соответственно, что указывает на то, что амаруциаксантин А накапливается преимущественно в жировой ткани, тогда как фукоксантинол накапливается в основном в других тканях. Сангита сообщили о различных метаболитах фукоксантина, помимо основных метаболитов фукоксантинола и амароуциаксантина А у крыс, предложили возможный путь метаболизма фукоксантина в плазме и печени крыс и предположили, что эти метаболиты могут образовываться в результате ферментативных реакций, таких как изомеризация, дегидрирование, деацетилирование, окисление и деметилирование. Таким образом, метаболиты фукоксантина считаются активными формами, осуществляющими физиологические функции в организме. Амаруциаксантин А хранится в белой жировой ткани брюшной полости (WAT); фукоксантинол поступает в кровоток и накапливается в эритроцитах, печени, легких, почках, сердце, селезенке и жировой ткани. На скорость абсорбции фукоксантина обычно влияет состав пищевой матрицы: например, его растворимость в соевом масле и других растительных маслах очень низкая, в то время как фукоксантин может легко растворяться в триацилглицеролах со средней длиной цепи (MCT) или в рыбьем жире.
.jpg)
3. Эффект против ожирения
Длительное несбалансированное питание изменяет липидный обмен и приводит к накоплению висцерального жира, что приводит к избыточной массе тела, ожирению и связанным с ними нарушениям обмена веществ, таким как сахарный диабет, артериальная гипертензия, дислипидемия и сердечно-сосудистые заболевания. Следовательно, решающим конечным результатом является поиск эффективных стратегий предотвращения ожирения. В этом смысле фукоксантин может оказывать действие против ожирения посредством нескольких механизмов. Фукоксантин значительно снижает концентрацию триглицеридов в плазме и печени.Рисунок 3) и положительно влияли на ферменты, регулирующие уровень холестерина, такие как 3-гидрокси-3-метилглутарил-коэнзим А-редуктаза и ацил-коэнзим А. Фукоксантин благотворно влияет на экспрессию генов, связанных с метаболизмом липидов: у крыс его прием снижал экспрессию мРНК печеночной ацетил-КоА-карбоксилазы (АСС), биотин-зависимого фермента, который катализирует необратимое карбоксилирование ацетил-КоА с образованием малонил-КоА. Функция ACC заключается в усилении метаболизма жирных кислот: когда фермент активен, вырабатывается малонил-КоА. Это представляет собой строительный блок для производства новых жирных кислот и ингибирует перенос жирных ацильных групп от ацил-КоА к карнитину с помощью карнитин-ацилтрансферазы, которая ингибирует бета-окисление жирных кислот в митохондриях. ACC1 обнаружен в цитоплазме всех клеток, но больше представлен в липогенных тканях, таких как жировая ткань и лактирующие молочные железы, где особенно важен синтез жирных кислот. Фукоксантин повышал уровни холестерина липопротеинов высокой плотности (ЛПВП) и не-ЛПВП-холестерина у мышей KK-Ay (модель мышей с нокаутом диабета 2 типа, которая демонстрирует выраженное ожирение, непереносимость глюкозы, тяжелую резистентность к инсулину, дислипидемию и гипертонию) за счет индукции экспрессии белка, связывающего регуляторный элемент стерола (SREBP), и снижения поглощения холестерина в печени за счет подавления рецептора липопротеинов низкой плотности (LDL) и SR-B1 (представитель класса B рецепторов-мусорщиков 1). Фактически, печеночные уровни белков LDL-R и SR-B1, которые являются важными факторами для поглощения холестерина ЛПНП и холестерина ЛПВП в печени из сыворотки, соответственно снизились до 60% и 80% у мышей, получавших фукоксантин. Кроме того, диетический фукоксантин значительно увеличивал экспрессию мРНК протеинконвертазы субтилизина/кексина типа 9 (PCSK9). Добавление фукоксантина также снижает экспрессию мРНК синтазы жирных кислот (FAS), мультиферментного белка, который катализирует синтез жирных кислот: его основная функция заключается в катализе синтеза пальмитата из ацетил-КоА и малонил-КоА в длинноцепочечные насыщенные жирные кислоты. . FAS исследовали как возможный онкоген, индикатор плохого прогноза и химиотерапевтическую мишень, но он также может быть вовлечен в продукцию эндогенного лиганда ядерного рецептора PPAR-α, мишени фибратных препаратов, вводимых против гиперлипидемии. Следовательно, в настоящее время он исследуется как возможная мишень для лечения метаболического синдрома. Недавно было установлено, что подавление стеароил-кофермента А-десатуразы-1 (SCD1) предотвращает ожирение и улучшает чувствительность к инсулину и лептину. Кроме того, уровни лептина в сыворотке были значительно снижены у мышей KK-A(y) с гиперлептинемией после 2 недель кормления фукоксантином, хотя у мышей ob/ob не наблюдалось подавляющего действия фукоксантина на SCD1 печени и увеличение массы тела.
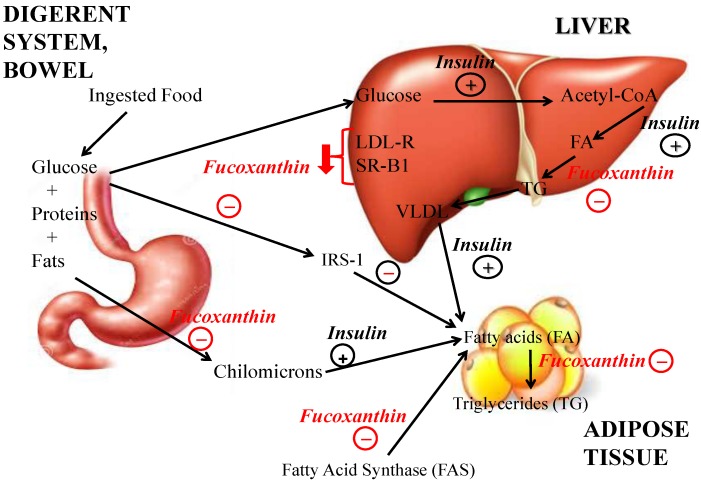
Влияние фукоксантина на потерю веса и метаболизм липидов по сравнению с инсулином: фукоксантин значительно снижает концентрацию триглицеридов в плазме и печени, а также поглощение холестерина в печени за счет подавления рецептора липопротеинов низкой плотности (ЛПНП) и рецептора-мусорщика класса B класса 1 ( СР-В1). Добавление фукоксантина также снижало экспрессию мРНК синтазы жирных кислот (FAS), которая катализирует синтез жирных кислот. Он также ингибировал поглощение глюкозы зрелыми адипоцитами за счет снижения фосфорилирования субстрата 1 инсулинового рецептора (IRS-1). Фукоксантин значительно снижает концентрацию триглицеридов в плазме и печени и положительно влияет на активность ферментов, регулирующих уровень холестерина, таких как 3-гидрокси-3-метилглутарил-КоА-редуктаза и ацил-КоА, а также влияет на экспрессию генов, связанных с метаболизмом липидов:
Фукоксантин также увеличивает уровень фермента глюкозо-6-фосфатдегидрогеназы (G6PDH), который участвует в пентозофосфатном пути, который поставляет энергию в клетки за счет поддержания уровня кофермента никотинамидадениндинуклеотидфосфата (NADPH). Это помогает поддерживать соответствующий клеточный уровень глутатиона, тем самым защищая от окислительного повреждения. Кроме того, фукоксантин также влиял на гидрокси-3-метилглутарил-кофермент А (ГМГ-КоА), ацил-КоА-холестерин-ацилтрансферазу (АСАТ), а также на факторы транскрипции, связывающие регуляторные элементы стерола (SREBP-1): SREBP-1a, чей активность регулируется уровнем стеролов в клетке, регулирует гены, связанные с продукцией липидов и холестерина и SREBP-1C, который регулирует гены, необходимые как для глюкозного метаболизма, так и для продукции жирных кислот/липидов; его экспрессия модулируется инсулином. Даже экспрессия мРНК лецитин-холестеролацилтрансферазы (LCAT), фермента, который превращает свободный холестерин в эфир холестерина, и карнитин-пальмитоил-трансферазы (CPT1) была значительно увеличена после введения фукоксантина. Неосинтезированный эфир холестерина затем изолируется в ядре липопротеиновой частицы, в результате чего вновь синтезированные ЛПВП. CPT1 представляет собой митохондриальный фермент, ответственный за образование ацилкарнитинов путем катализа переноса ацильной группы длинноцепочечного ацил-КоА жирного ряда от кофермента А к L-карнитину, что является важной стадией бета-окисления длинноцепочечного ацил-КоА. жирные кислоты. В настоящее время известны три изоформы CPT1: CPT1A, присутствующая в печени, CPT1B в мышцах и CPT1C в головном мозге. Этот фермент может быть ингибирован малонил-КоА, первым промежуточным продуктом, образующимся при синтезе жирных кислот. Его роль в метаболизме жирных кислот делает CPT1 важным при многих нарушениях обмена веществ, таких как диабет и резистентность к инсулину. При этих метаболических заболеваниях уровни свободных жирных кислот (СЖК) повышаются, жировая ткань накапливается в скелетных мышцах, а способность мышц окислять жирные кислоты медленно снижается. Повышенные уровни малонил-КоА, вызванные гипергликемией и гиперинсулинемией, ингибируют СРТ1; Ингибирование CPT1 вызывает последующее снижение транспорта длинноцепочечных жирных кислот в митохондрии мышц и сердца, тем самым уменьшая окисление жирных кислот в таких клетках. Шунтирование LCFAs от митохондрий приводит к наблюдаемому увеличению уровней FFA и накоплению жира в скелетных мышцах. В этом отношении активация CPT1 фукоксантином играет решающую роль в предотвращении и ограничении этих симптомов. Шунтирование LCFAs от митохондрий приводит к наблюдаемому увеличению уровней FFA и накоплению жира в скелетных мышцах. В этом отношении активация CPT1 фукоксантином играет решающую роль в предотвращении и ограничении этих симптомов. Шунтирование LCFAs от митохондрий приводит к наблюдаемому увеличению уровней FFA и накоплению жира в скелетных мышцах. В этом отношении активация CPT1 фукоксантином играет решающую роль в предотвращении и ограничении этих симптомов. Маэда и др. сообщили, что повышенная экспрессия мРНК моноцитарного хемоаттрактантного белка-1 (MCP-1) наблюдалась у мышей с высоким содержанием жира (HF), но нормализовалась в группе, получавшей липиды, богатые фукоксантином (FLs): диета HF-FL могла подавлять высокое содержание жира ( HF) ожирение, вызванное диетой у мышей. Ву и др. также обнаружили, что экспрессия мРНК ацил-КоА-оксидазы1, пальмитоила (ACOX1) и пролифераторов пероксисом активирует рецептор α (PPARα) и γ (PPARγ), который является важным модулятором экспрессии UCP1, очевидно, были модифицированы фукоксантином. Недавние исследования показали, что дифференцировка преадипоцитов делится на раннюю (0-2 дни, D0-D2), промежуточную (2-4 дни, D2-D4) и позднюю стадии (4-й день и далее, D4). Фукоксантин оказывает различное воздействие на клетки на трех стадиях дифференцировки: на ранних стадиях дифференцировки (D0–D2) фукоксантин способствует дифференцировке адипоцитов и увеличивает экспрессию белка PPARγ, CCAAT/энхансер-связывающего белка α (C/EBPα), стерол-регуляторного элемента- связывающий белок 1c (SREBP1c) и экспрессия мРНК адипонектина. Однако фукоксантин ингибирует межклеточное накопление липидов за счет снижения экспрессии PPARγ, C/EBPα и SREBP1c на промежуточных (D2–D4) и поздних стадиях (D4–D7) дифференцировки. Кроме того, сообщалось, что метаболит фукоксантина, фукоксантинол, подавляет PPARγ и оказывает более сильное подавляющее действие, чем фукоксантин, на дифференцировку адипоцитов. Также было показано, что амаруциаксантин А, другой метаболит фукоксантина, подавляет экспрессию PPARγ и C/EBPα во время дифференцировки адипоцитов. По сравнению с фукоксантинолом, амароуциаксантин А заметно снижает экспрессию мРНК белка, связывающего жирные кислоты адипоцитов (aP2), липопротеинлипазы (LPL) и переносчика глюкозы 4 (Glut-4). Следовательно, на молекулярном уровне фукоксантин увеличивал экспрессию белков PPARγ, C/EBPα, SREBP1c, aP2 и экспрессию мРНК адипонектина дозозависимым образом на ранней стадии дифференцировки адипоцитов, одновременно снижая экспрессию PPARγ, C/EBPα, и SREBP1c на промежуточной и поздней стадиях дифференцировки. Он также подавлял поглощение глюкозы зрелыми адипоцитами.Рисунок 3) за счет снижения фосфорилирования субстрата 1 инсулинового рецептора (IRS-1). Эти результаты свидетельствуют о том, что фукоксантин по-разному влияет на разные стадии дифференцировки и ингибирует поглощение глюкозы зрелыми адипоцитами.
3.1. Фукоксантин и разобщающие белки: адаптивный термогенез как физиологическая защита от ожирения
Недавняя литература предполагает, что фукоксантин оказывает действие против ожирения, главным образом, путем стимуляции экспрессии разобщающего белка-1 (UCP-1) в белой жировой ткани (WAT). Этот белок, расположенный во внутренней клеточной мембране митохондрий, обычно обнаруживается в бурой жировой ткани (БЖТ) и не экспрессируется в БЖТ в отсутствие какой-либо стимуляции. Физиологический обмен веществ определяет выработку тепла: этот процесс называется термогенезом, и UCP-1 рассеивает градиент pH, создаваемый окислительным фосфорилированием, посредством высвобождения химической энергии в виде тепла. UCP1экспрессия генов, которая стимулируется многими факторами, такими как холод, β3-агонисты, адренергическая стимуляция и гормоны щитовидной железы, представляет собой значительную часть расхода энергии организмом, ее дисфункция является важной причиной увеличения веса и важным кофактором развития ожирение. Фукоксантин увеличивает количество энергии, которая высвобождается в виде тепла в жировой ткани, тем самым стимулируя термогенез. UCP-1 и мРНК могли быть обнаружены в WAT, когда экспериментальные животные получали липиды Undaria , содержащие фукоксантин: 0,2% фукоксантина в их рационе значительно ослабляло увеличение веса у мышей за счет увеличения экспрессии UCP-1. Эта индукция UCP1 также в белой жировой ткани (WAT) фукоксантином и его производными приводит к окислению жирных кислот и выработке тепла в WAT. Этот адаптивный термогенез играет решающую роль в расходе энергии в виде тепла, чтобы ограничить увеличение веса и способствовать его снижению. Было обнаружено, что фукоксантин способствует экспрессии не только белка UCP1 и мРНК в WAT тучных животных, но и β3-адренорецептора (Adrb3), который отвечает за липолиз и термогенез.Рисунок 4. Эта повышенная чувствительность к стимуляции симпатического нерва может привести к дальнейшему усилению окисления жиров в WAT. Добавка фукоксантина также была протестирована на людях для снижения веса: 16-недельный прием 4,0 мг / день показал значительное увеличение расхода энергии в покое (REE), которое было измерено с помощью непрямой калориметрии. Это увеличение РЗЭ оказалось еще более важным при дозе 8 мг. Значительное снижение массы тела и жира у лиц с ожирением приводило к подавлению воспалительных и печеночных маркеров, таких как С-реактивный белок (СРБ), глутаминовая пировиноградная трансаминаза (ГПТ), глутаминовая щавелевоуксусная трансаминаза (ГОТ), γ-глутамилтранспептидаза. (γGT), тем самым предотвращая метаболический синдром. Кроме того, было высказано предположение, что фукоксантин улучшает резистентность к инсулину и снижает уровень глюкозы в крови, по крайней мере, частично, за счет подавления адипокинов, фактора некроза опухоли-α, моноцитарного хемоаттрактантного белка-1, интерлейкина-6 и ингибитора активатора плазминогена-1. потому что он подавляет экспрессию их мРНК, непосредственно действуя на адипоциты и макрофаги в белой жировой ткани. Кроме того, фукоксантин действует посредством повышающей регуляции переносчика глюкозы 4 в скелетных мышцах.
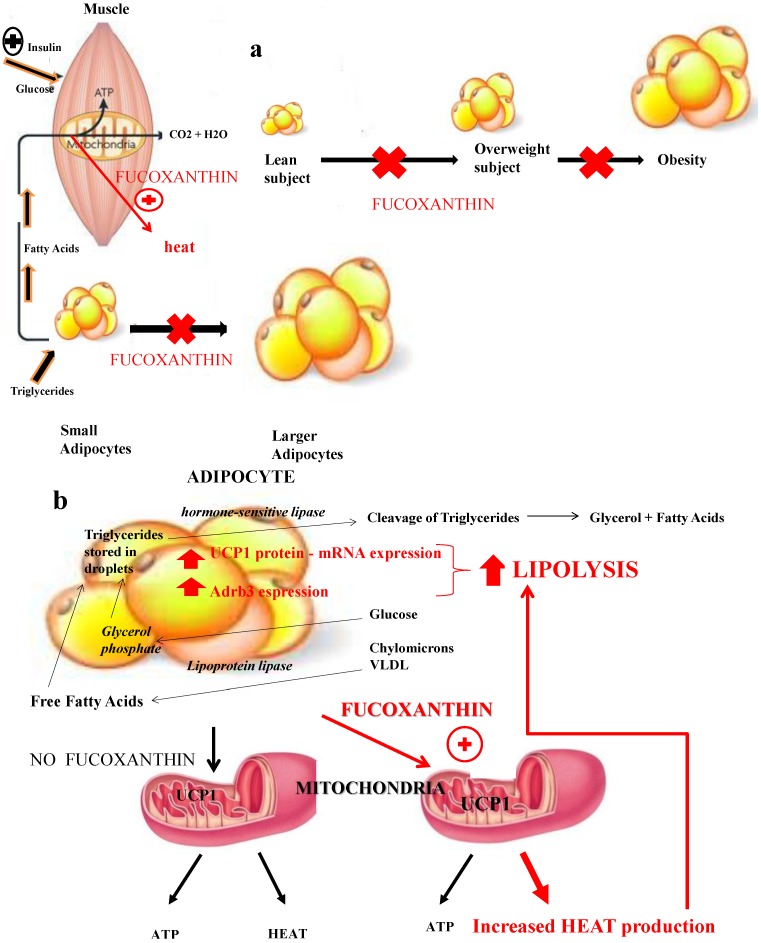
Рисунок 4 Влияние фукоксантина на термогенез и липолиз: мышцы ( а ) и жировая ткань ( б).). Фукоксантин оказывает действие против ожирения, главным образом, за счет стимуляции экспрессии разобщающего белка-1 (UCP-1) в белой жировой ткани (WAT). Этот белок, расположенный во внутренней клеточной мембране митохондрий, обычно обнаруживается в бурой жировой ткани (БЖТ) и не экспрессируется в БЖТ в отсутствие какой-либо стимуляции. Физиологический обмен веществ определяет выработку тепла: этот процесс называется термогенезом, и UCP-1 рассеивает градиент pH, создаваемый окислительным фосфорилированием, высвобождая химическую энергию в виде тепла. Было обнаружено, что фукоксантин способствует экспрессии не только белка UCP1 и мРНК, но и β3-адренергического рецептора (Adrb3), который отвечает за липолиз и термогенез. Эта повышенная чувствительность к стимуляции симпатического нерва может привести к дальнейшему усилению окисления жиров в WAT.
3.2. Регуляция фукоксантина и лептина
Гормон лептин в основном экспрессируется в дифференцированных адипоцитах белой жировой ткани и играет решающую роль в поддержании гомеостатического контроля жировой ткани и массы тела, регулируя потребление пищи и расход энергии через несколько нервных и эндокринных механизмов. При ожирении экспрессия гена лептина и его циркулирующая концентрация повышены без какого-либо регуляторного влияния на массу тела, с развитием резистентности. После своего открытия лептин стал большой надеждой в качестве средства против ожирения из-за его способности снижать потребление пищи и увеличивать расход энергии. Тем не менее, лечение людей с ожирением экзогенным лептином оказалось в основном безуспешным, поскольку у них уже наблюдается высокий уровень циркулирующего лептина, на который они больше не реагируют: эта ситуация определяет состояние резистентности к лептину. Фукоксантин может изменять уровень лептина в плазме для достижения действия против ожирения. Во многих предыдущих исследованиях сообщалось, что секреция лептина повышается из-за накопления жира в адипоцитах, и лептин может контролировать массу тела и жировую прослойку посредством регуляции расхода энергии: в частности, Park et al провел исследование, оценивающее благотворное влияние ундарии перистонадрезанной.этанола у мышей C57BL/6J и обнаружили, что фукоксантин может значительно снизить уровень лептина в плазме, что было связано со значительным снижением веса эпидидимальной жировой ткани. В этом исследовании добавка фукоксантина заметно уменьшила размер адипоцитов по сравнению с контрольной группой. Уровень глюкозы в крови натощак, уровень лептина плазмы и инсулина были достоверно выше в контрольной группе в 1,5–2,3 раза. Фукоксантин значительно снизил уровень глюкозы в крови на 19,8% и уровень инсулина примерно на 33% по сравнению с контролем. Концентрация лептина в плазме продемонстрировала положительную корреляцию с массой тела и снизилась после приема фукоксантина. Другое релевантное исследование показало, что фукоксантин подавляет стеароил-коэнзим А-десатуразу-1 (SCD1) с последующим улучшением чувствительности к инсулину и лептину. тем самым способствуя профилактике ожирения. Фактически, SCD1 является ферментом, ограничивающим скорость, который катализирует биосинтез мононенасыщенных жирных кислот из насыщенных жирных кислот. Диета, содержащая 0,2% фукоксантина в течение 2 недель у тучных мышей с моделями гиперлептинемии KK-A(y), заметно подавляла экспрессию мРНК и белка SCD1 в печени. Кроме того, уровни лептина в сыворотке были значительно снижены у мышей KK-A(y) с гиперлептинемией после 2 недель кормления фукоксантином, хотя у мышей ob/ob не наблюдалось подавляющего действия фукоксантина на печеночную SCD1 и увеличение массы тела. Эти результаты показывают, что фукоксантин подавляет экспрессию SCD1 и изменяет состав жирных кислот в печени посредством регуляции передачи сигналов лептина у мышей KK-A(y) с гиперлептинемией, но не у мышей ob/ob с дефицитом лептина. SCD1 представляет собой фермент, ограничивающий скорость, который катализирует биосинтез мононенасыщенных жирных кислот из насыщенных жирных кислот. Диета, содержащая 0,2% фукоксантина в течение 2 недель у тучных мышей с моделями гиперлептинемии KK-A(y), заметно подавляла экспрессию мРНК и белка SCD1 в печени. Кроме того, уровни лептина в сыворотке были значительно снижены у мышей KK-A(y) с гиперлептинемией после 2 недель кормления фукоксантином, хотя у мышей ob/ob не наблюдалось подавляющего действия фукоксантина на печеночную SCD1 и увеличение массы тела. Эти результаты показывают, что фукоксантин подавляет экспрессию SCD1 и изменяет состав жирных кислот в печени посредством регуляции передачи сигналов лептина у мышей KK-A(y) с гиперлептинемией, но не у мышей ob/ob с дефицитом лептина. SCD1 представляет собой фермент, ограничивающий скорость, который катализирует биосинтез мононенасыщенных жирных кислот из насыщенных жирных кислот. Диета, содержащая 0,2% фукоксантина в течение 2 недель у тучных мышей с моделями гиперлептинемии KK-A(y), заметно подавляла экспрессию мРНК и белка SCD1 в печени. Кроме того, уровни лептина в сыворотке были значительно снижены у мышей KK-A(y) с гиперлептинемией после 2 недель кормления фукоксантином, хотя у мышей ob/ob не наблюдалось подавляющего действия фукоксантина на печеночную SCD1 и увеличение массы тела. Эти результаты показывают, что фукоксантин подавляет экспрессию SCD1 и изменяет состав жирных кислот в печени посредством регуляции передачи сигналов лептина у мышей KK-A(y) с гиперлептинемией, но не у мышей ob/ob с дефицитом лептина.21]. На жирнокислотный состав липидов печени также повлияло наблюдаемое снижение отношения олеиновой кислоты к стеариновой кислоте. У этих животных с резистентностью к лептину снижение уровня лептина (которое у нормальных животных должно привести к увеличению потребления пищи) имеет положительный эффект. Эти результаты показывают, что фукоксантин подавляет экспрессию SCD1 и изменяет состав жирных кислот в печени посредством регуляции передачи сигналов лептина у мышей KK-Ay с гиперлептинемией, но не у мышей ob/ob с дефицитом лептина. Не только лептин, но также орексин и грелин участвуют в регуляции энергетического гомеостаза. Уровни этих веществ демонстрируют циркадные колебания, а нарушения этих ритмов наблюдались при ожирении и метаболическом синдроме. С одной стороны, уровень лептина в сыворотке крови повышается ночью, в то время как уровни орексина в спинномозговой жидкости увеличиваются во время активной фазы; с другой стороны, концентрация грелина в плазме повышалась перед едой и ночью. Высокие концентрации лептина во время сна помогают поддерживать сон за счет подавления пищевого поведения и возбуждения за счет ингибирования нейропептида Y и орексиновых нейронов, в то время как высокие концентрации грелина перед едой могут усиливать бодрствование за счет активации орексиновых нейронов. Эти недавние открытия позволяют предположить, что циркадные ритмы этих веществ важны для поддержания основного метаболизма и нормального энергетического гомеостаза. Открытие того, что орексиновые нейроны регулируются периферическими метаболическими сигналами, включая грелин и лептин, и что они могут играть важную роль в качестве связующего звена между координацией питания и состояниями сна/бодрствования, предполагает роль орексина в поддержании энергетического гомеостаза. Кроме того, основной обмен и расход энергии также влияют на контроль аппетита, кормление и потребление энергии: это динамическое взаимодействие затрудняет предсказание результирующего сдвига энергетического баланса и, следовательно, изменения веса. Хорошо известно, что основное влияние на чувство голода и последующий контроль веса оказывают безжировая масса и жировая масса, скорость метаболизма в покое, приспособление желудка к съеденной пище, изменения в эпизодических и циркадных пептидах, таких как инсулин, грелин, холецистокинин, глюкагон. как пептид-1 и лептин. Изучение потенциального взаимодействия фукоксантина с этими пептидами и другими нейропептидами, регулирующими потребление пищи и обмен веществ, может открыть новые горизонты: специфические действия фукоксантина на каждый физиологический компонент, а также возможное взаимодействие с составом пищи представляют собой интересную цель для будущих исследований.
4. Ожирение и неалкогольная жировая болезнь печени: гепатопротекторный эффект фукоксантина.
Повышенное окисление жирных кислот способствует улучшению состояния печени за счет уменьшения количества жирных кислот в качестве субстратов для синтеза триацилглицерина. Фукоксантин увеличивает окисление жирных кислот и снижает содержание липидов в печени, регулируя активность метаболических ферментов и стимулируя активность β-окисления [ 4 ]. Фактически, содержание липидов в печени оказалось заметно ниже после приема фукоксантина по сравнению с контрольной группой, поскольку фукоксантин ингибирует печеночные липогенные ферменты, глюкозо-6-фосфатдегидрогеназу, яблочный фермент, синтазу жирных кислот и фосфатидатфосфогидролазу, которые участвуют в печеночной недостаточности. липидная капля (Рисунок 5); кроме того, фукоксантин стимулирует активность β-окисления. Сообщалось, что фукоксантин и его метаболит фукоксантинол повышают долю докозагексаеновой кислоты (ДГК) в печени мышей. Фукоксантин значительно повышал уровень гликолитического фермента, такого как глюкокиназа, в печени и, таким образом, повышал соотношение печеночной глюкокиназы/глюкозо-6-фосфатазы и содержания гликогена, указывая на то, что фукоксантин нормализовал содержание печеночного гликогена у мышей с высоким содержанием жира. Снижение содержания липидов в печени может быть связано с повышением уровня докозагексаеновой кислоты, которая снижает активность печеночных ферментов в синтезе жирных кислот и увеличивает β-окисление жирных кислот в печени. Фукоксантин и фукоксантинол увеличивали количество докозагексаеновой кислоты в печени мышей KK-Ay, в то время как уровень докозагексаеновой кислоты в тонком кишечнике оставался неизменным. Кроме того, у мышей, получавших фукоксантин, также было обнаружено увеличение уровня арахидоновой кислоты, что указывает на то, что фукоксантин может модифицировать метаболические пути высоконенасыщенных жирных кислот ω-3 и ω-6. Недавно Айранти и соавт. показали, что уровни докозагексаеновой кислоты и арахидоновой кислоты в липидах печени мышей KK-Ay, получавших липиды из бурых водорослей, значительно увеличились. Недавние фармакологические исследования на моделях животных с неалкогольной жировой болезнью печени (НАЖБП) и у взрослых людей, которые демонстрируют как противовоспалительные, так и сенсибилизирующие свойства ДГК, предполагают потенциальную роль фукоксантина в лечении НАЖБП.
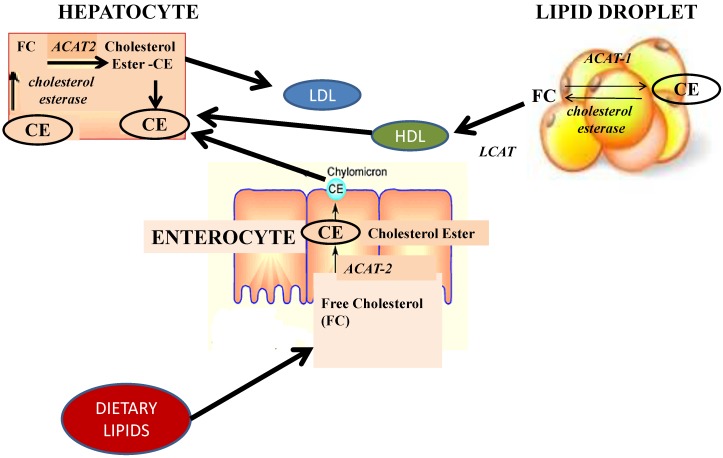
Рисунок 5
Влияние фукоксантина на глюкозный и липидный обмен: от энтероцита к гепатоциту. Фукоксантин увеличивает окисление жирных кислот и снижает содержание липидов в печени, регулируя активность метаболических ферментов и стимулируя активность β-окисления. Содержание липидов в печени оказалось заметно ниже после приема фукоксантина, поскольку фукоксантин ингибирует печеночные липогенные ферменты, глюкозо-6-фосфатдегидрогеназу, яблочный фермент, синтазу жирных кислот и фосфатидатфосфогидролазу, которые участвуют в липидной капле печени. Кроме того, можно постулировать важный эффект фукоксантина на энтероциты, такой как конкуренция с абсорбцией липидов.
5. Ожирение и окислительный стресс: антиоксидантное и противовоспалительное действие фукоксантина.
Диета с высоким содержанием жиров может вызвать ожирение, а ожирение вызывает перепроизводство активных форм кислорода (АФК), которые ответственны за повреждение клеток. Химическая структура фукоксантина содержит эпоксидную группу и гидроксильную группу, которые считаются сильными антиоксидантами, поэтому его добавка может уменьшить окислительный стресс. В естественных условияхэксперименты определили некоторые маркеры антиоксидантной способности, такие как общая антиоксидантная способность плазмы (ТАС), антиоксидантные ферменты, такие как каталаза, супероксиддисмутаза (СОД) и глутатионпероксидаза (GSH-Px), экспрессия мРНК фактора транскрипции, такого как ядерный эритроидный фактор, такой как 2 (Nrf2) и его гены-мишени, такие как NADPH-хиноноксидоредуктаза 1 (NQO1). Плазменная активность GSH-Px у крыс, получавших диету с высоким содержанием жиров и фукоксантин, была значительно выше по сравнению с группой, получавшей диету с высоким содержанием жиров и не получавшей фукоксантин. Плазматический уровень TAC, экспрессия мРНК Nrf2 и NQO1, активность каталазы и GSH-Px в печени также были значительно выше в группе, получавшей добавки.
Чтобы определить, активирует ли фукоксантин клеточные антиоксидантные ферменты посредством активации пути Nrf2 / элемента антиоксидантного ответа (ARE), было проведено интересное исследование путем инкубации клеток мышиной печени BNL CL.2 с фукоксантином в течение 24 часов. Фукоксантин (≥5 мкМ) приводил к увеличению АФК через 6 часов инкубации, тогда как предварительная инкубация с α-токоферолом (30 мкМ) снижала увеличение АФК, что указывает на прооксидантную природу фукоксантина. Фукоксантин значительно усиливал внеклеточные регулируемые сигналом киназы (ERK) и фосфорилирование p38 и заметно увеличивал накопление 2-подобного 2-подобного белка ядерного фактора эритроидного происхождения (Nrf2) после инкубации в течение 12 часов. Более того, фукоксантин значительно увеличивал связывающую активность ядерного Nrf2 с ARE и увеличивал экспрессию мРНК и белка гемоксигеназы-1 (HO-1), фермент, который индуцируется в ответ на стресс, и НАД(Ф)Н-дегидрогеназа хинон-1 (NQO1) после инкубации в течение 12 часов. Таким образом, фукоксантин может проявлять свою антиоксидантную активность, по крайней мере частично, за счет своего прооксидантного действия.53 ]. Путь MAPK/ERK представляет собой цепь белков в клетке, которая передает сигнал от рецептора на поверхности клетки к ДНК в ядре клетки. Когда один из белков в пути мутирует, он может застрять в положении «включено» или «выключено», что является необходимым шагом в развитии многих видов рака. Компоненты пути MAPK/ERK были обнаружены, когда они были обнаружены в раковых клетках. Лекарства, которые обращают этот переключатель вспять, исследуются как средства для лечения рака [ 54 ]. В частности, фукоксантин проявлял противоопухолевую активность в клетках лейкемии человека HL-60 посредством индукции апоптоза [ 55].]: это исследование было сосредоточено на влиянии индукции фукоксантина на накопление АФК и на запуск сигнального пути Bcl-xL в клетках HL-60, определяя, что АФК генерируются во время индуцированной фукоксантином цитотоксичности и апоптоза в клетках HL-60, и что N -ацетилцистеин (NAC), поглотитель АФК, ингибирует индуцированную фукоксантином цитотоксичность и апоптоз. В этом исследовании было показано, что фукоксантин генерирует АФК и что накопление АФК играет фундаментальную роль в индуцированном фукоксантином сигнальном пути Bcl-xL.
.Ким и др. исследовали противовоспалительные эффекты фукоксантина в мышиных макрофагах, стимулированных липополисахаридом (ЛПС), и показали, что фукоксантин может снижать уровни провоспалительных медиаторов, таких как NO, PGE 2 , IL-1β , TNF-α и IL. -6 путем подавления активации NF-κB и фосфорилирования MAPK. Эти противовоспалительные действия фукоксантина также были продемонстрированы in vivo [ 57 ]: фукоксантин заметно ингибировал антиген-индуцированное высвобождение β-гексозаминидазы как в клетках базофильного лейкоза 2H3 крыс, так и в тучных клетках, полученных из костного мозга мыши; кроме того, он подавлял индуцированную антигеном агрегацию высокоаффинного рецептора IgE, который играет решающую роль в регуляции сигналов тучных клеток.
6. Генетические и ятрогенные аспекты ожирения: потенциал фукоксантина
Генетические и ятрогенные факторы играют важную роль в развитии заболеваний, связанных с образом жизни, таких как сахарный диабет 2 типа (СД2) и ожирение, и хорошо известно, что у генетически предрасположенных субъектов могут развиться эти метаболические заболевания после воздействия факторов риска окружающей среды. . В связи с этим в последнее время были предприняты большие усилия по выявлению генов, связанных с избыточным весом и ожирением. UCP1 в основном экспрессируется в бурой жировой ткани и участвует в термогенезе, регуляции расхода энергии и защите от окислительного стресса, как обсуждалось выше: все эти механизмы связаны с патогенезом не только ожирения, но и СД2. Следовательно, ген UCP1 вовлечен в развитие этих нарушений: в нескольких исследованиях сообщается, что полиморфизмы -3826A/G , -1766A/G и -112A/C в его промоторной области, Ala64Thr в экзоне 2 и Met299Leu в экзоне 5, возможно, связаны с ожирением. Подобно UCP1, ген β3-адренергического рецептора (β3-AR) экспрессируется в BAT и WAT и играет важную роль в индукции липолиза и регуляции энергетического гомеостаза. Кроме того, это основной адренорецептор, стимулирующий экспрессию UCP1. Полиморфизм Trp64Arg в гене β3-AR был связан с увеличением веса и другими показателями, связанными с ожирением, а также с резистентностью к инсулину в различных популяциях. Интересно, что в литературе показано, что синергетический эффект между полиморфизмом -3826A/G гена UCP1 и полиморфизмом Trp64Arg гена β3-AR связан с повышенной тенденцией к увеличению веса, устойчивостью к потере веса или последующим поддержанием веса. после низкокалорийной диеты. Напротив, некоторые исследования не показали никакого влияния взаимодействия между этими двумя полиморфизмами на устойчивость к низкокалорийной диете, ИМТ и другие метаболические параметры, связанные с ожирением. Этнические и возрастные различия, а также факторы окружающей среды и синергетический эффект с другими генами могут объяснить эти противоречивые результаты различных исследований. Ожирение может быть вызвано различными факторами: экологическими, генетическими, личными и часто медицинскими. Важный побочный эффект лекарств представлен увеличением веса и даже ятрогенным ожирением: ряд лекарств может способствовать увеличению веса или препятствовать его снижению, а альтернативы, нейтральные по весу, часто недоступны. Некоторые, возможно, адипогенные препараты представлены психоактивными препаратами, такими как нейролептики и антидепрессанты. Увеличение веса является хорошо задокументированным побочным эффектом антипсихотического лечения. Как правило, она не пропорциональна дозе и может варьироваться от минимальной прибавки в весе в течение нескольких лет до огромной в течение нескольких месяцев. Как типичные, так и новые нейролептики связаны с увеличением веса, но новые нейролептики, особенно клозапин и оланзапин, обладают наибольшим адипогенным потенциалом и несут наибольший риск развития гипертонии, диабета и нарушений липидного обмена. Хотя прекращение приема антипсихотических препаратов у пациентов, страдающих психозом, не рекомендуется, эти лекарства все чаще используются не по прямому назначению в качестве стабилизаторов настроения и снотворных. Антипсихотики второго поколения были связаны с повышенной склонностью к увеличению веса и метаболическим побочным эффектам. Среди них клозапин и оланзапин проявляли большую склонность к увеличению массы тела и метаболическим побочным реакциям. Недавнее исследование показало, что использование оланзапина и клозапина было связано с изменениями уровня лептина, адипоцитокинов и общего грелина: оланзапин больше влиял на адипонектин и общий грелин, чем клозапин. Изменения адипоцитокинов и общего грелина были прямым влиянием нейролептиков на гормональные пути энергетического гомеостаза, а не результатом увеличения массы тела: в этом отношении потенциальное взаимодействие фукоксантина с UCP-1 и с этими пептидами и другими нейропептидами, регулирующими потребление пищи и метаболизм, может оказаться полезным во время антипсихотического лечения для ограничения последующего увеличения веса. Также трициклические антидепрессанты часто связаны с увеличением веса. Амитриптилин, по-видимому, обладает наибольшим потенциалом ожирения. Снижение расхода энергии, по-видимому, является причиной эффекта, способствующего увеличению массы тела, в то время как изменения в рационе питания способствуют в меньшей степени. Прибавка в весе, обычно связанная с повышенным потреблением пищи, также характерна для лечения литием (где оно зависит от дозы и чаще возникает у женщин с избыточным весом) и для противоэпилептических препаратов, в частности вальпроата и карбамазепина. Было обнаружено, что ряд других лекарств вызывает увеличение веса и способствует ожирению у пациентов: стероиды, которые увеличивают абдоминальное ожирение и резистентность к инсулину, тем самым повышая риск диабета и сердечно-сосудистых заболеваний; антигистаминные, которые часто делают больных вялыми, так что им труднее выполнять физические упражнения; антибиотики, влияющие на микробиоту в кишечной системе. Фактически, накапливая свидетельства указывает на то, что микробиота кишечника играет значительную роль в развитии ожирения, воспаления, связанного с ожирением, и резистентности к инсулину. То, как микробиота способствует здоровью и болезням человека, является обширной областью исследований, которая, вероятно, приведет к фундаментальным открытиям в области энергетического метаболизма и может привести к новым стратегиям предотвращения ожирения и его осложнений. Таким образом, некоторые лекарства связаны с изменением веса различной величины, это осознание должно направлять выбор препарата, когда существует несколько вариантов, и способствовать внедрению упреждающих стратегий для управления весом, таких как добавки фукоксантина, когда назначаются препараты с известными эффектами веса.
7. Выводы
Ожирение является многофакторным заболеванием, связанным как с генетическими факторами, так и с факторами окружающей среды. Знание факторов, связанных с этими расстройствами, позволяет нам лучше понять их и может предложить более эффективные подходы к лечению и профилактике. В этом отношении фукоксантин обладает многими видами биологической активности, потенциально способствующими укреплению здоровья человека. В частности, его потенциальный эффект против ожирения был впервые обнаружен в исследованиях на мышах, которые показали индукцию разобщающего белка-1 в митохондриях белой жировой ткани брюшной полости, что приводит к окислению жирных кислот и выработке тепла. Даже если потребуются дальнейшие исследования, чтобы подтвердить эти результаты и на людях, все многообещающие научные открытия могут позволить в будущем развивать его как морской нутрицевтик и интересную функциональную пищу. Однако, хорошо известно, что на основной обмен, аппетит и потребление пищи влияют многие другие факторы, включая возраст, пол, состав тела, уровни физической активности, факторы окружающей среды (такие как температура), а также индивидуальные различия. Эти факторы, вероятно, влияют на баланс гомеостатического контроля и затрудняют обобщение; тем не менее, исследования и развитие знаний в этой области дают надежду на то, что потенциальные новые стратегии контроля веса могут появиться на горизонте.



